Co jsou van der Waalsovy síly
Jsou to slabé interakce působící mezi libovolnými molekulami popřípadě atomy. Jejich velikost závisí na vzájemné vzdálenosti. V tomto ohledu nezaměňujte van der Waalsovy interakce s klasickou chemickou vazbou (tak jak ji znáte z hodin chemie = kovalentní, iontová, apod.). Pro lepší pochopení principu těchto sil se nejprve seznámíme s pojmy jako polarita molekul, dipól a dipólový moment.

Dipólový moment
Představte si molekulu složenou z nestejných atomů (HCl). Chlór má vyšší elektronegativitu než vodík, tedy elektronový pár si přitáhne blíže k sobě (to ovšem neznamená, že vodík svůj elektron zcela ztratí). Vzhledem k tomu, že elektron je záporně nabitou částicí, vzniká v jeho bezprostřední blízkosti částečný (parciální) záporný náboj. A naopak, v okolí vodíku, který o svůj elektron téměř přišel, vzniká částečný (parciální) kladný náboj. Čím je posun vazebných elektronů větší, tím jsou vzniklé náboje větší. Tyto parciální náboje značíme δ+ a δ-. V tomto ohledu často používáme pojem dipól (obecně je dipól tvořen dvěma od sebe oddělenými elektrickými náboji stejné velikosti, ale opačné polarity). Velikost dipólu lze vyjádřit pomocí dipólového momentu µ. Ten je dán součinem délky vazby l a parciálního náboje δ. Dipólový moment µ je vektorová veličina a je orientovaná od záporného pólu ke kladnému. Obrázek níže popisuje dipólový moment dvouatomové molekuly.
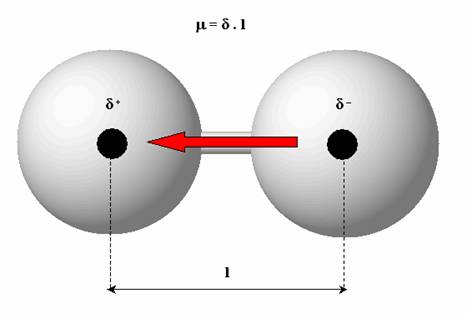
dipólový moment dvouatomové molekuly
U tříatomových molekul typu AB2 je složitější určit dipólové momenty. Vzhledem k tomu, že dipólový moment je vektorová veličina, tak výsledný dipólový moment je vektorovým součtem všech jednotlivých dipólových momentů v molekule. Pokud je vektorový součet všech dipólových momentů molekul různý od nuly, molekula je polární.
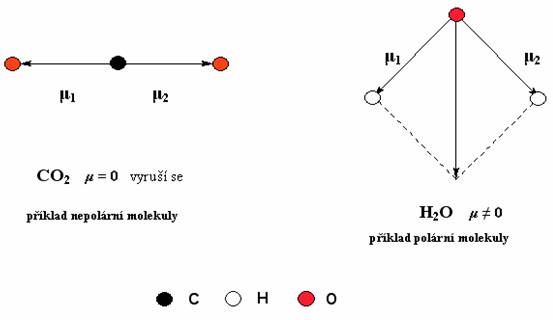
Polární molekula
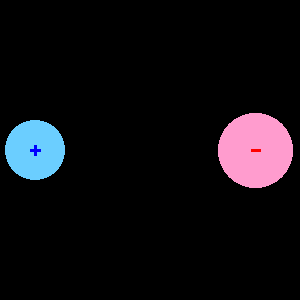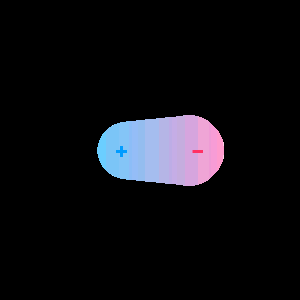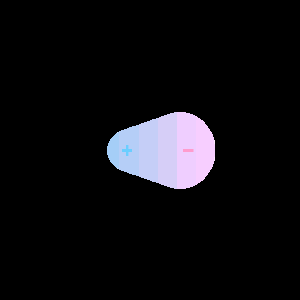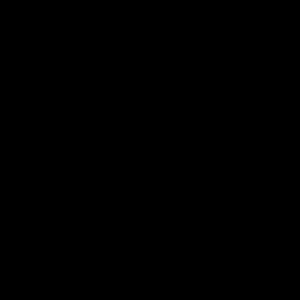

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
Nepolární molekula

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
Obecně pro víceatomové molekuly zachováváme stejný princip a celkový dipólový moment je vektorovým součtem všech dílčích dipólových momentů v molekule.
Dipól nemusí nutně vznikat jen v molekulách tvořených atomy s nestejnou elektronegativitou. Jiný mechanismus vzniku dipólů spočívá v rozložení elektronů v atomu či molekule, které se neustále mění. Krátkodobě se stane, že na jedné straně molekuly či atomu je více elektronů než na straně druhé. Původně „nepolární“ molekula či atom se v tomto okamžiku jeví jako dipól.
K tomuto okamžitému rozložení může dojít náhodně, ale také v důsledku působení jiné polární molekuly nebo iontu. Při přiblížení například záporně nabité částice k původně nepolární molekule nebo atomu dojde k odpuzování elektronů v obalu směrem od iontu a naopak k přitažení kladného jádra směrem k iontu. Tím dojde k separaci nábojů a vzniku dipólu. Takový dipól, který vznikne působením jiné částice, se nazývá indukovaný. Vzhledem k tomu, že tento dipól po skončení působení nabité nebo polární částice zase zaniká, nazývá se současně dočasný dipól. Je zřejmé, že v molekulách tvořených atomy s nestejnou elektronegativitou (např. již zmiňovaná HCl), dipól nezaniká a zůstává stále. Proto se nazývá stálý neboli permanentní.
Právě na základě vzájemného působení dipólů jsou založeny Van der Waalsovy slabé interakce.
V podstatě jde o přitahování popřípadě odpuzování nabitých konců permanentních dipólů, popřípadě dočasných dipólů. Tím mohou molekuly a atomy spolu vzájemně interagovat, ovlivňují se a tím pádem se například u plynů objevují odchylky od ideálního chování. Za určitých podmínek jsou takové molekuly schopny tvořit vyšší nadmolekulární struktury, například molekulové krystaly.
Podle toho, které dipóly spolu interagují, dělíme van der Waalsovy interakce následovně:
1. disperzní síly
Nejslabší síly, které obvykle působí mezi nepolárními molekulami (např. F2, O2, N2), nebo mezi atomy (Ar, Ne, atd.). Jedná se vlastně o vzájemné interakce dočasných dipólů.

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
2. interakce dipól - dipól
Nejsilnější interakce z van der Waalsových, která se projevuje zejména u polárních molekul (H2O, HCl). Podstatou je elektrostatické přitahování opačně nabitých pólů polárních molekul, tedy v podstatě interakce dvou permanentních dipólů.
Uplatňuje se v pevných, kapalných a plynných látkách. Kromě jiného lze pomocí těchto interakcí vysvětlit rozpustnost polární látky v polárním rozpouštědle (H2O, C2H5OH). Polární molekula je obklopena polárními molekulami rozpouštědla – tzv. solvatovým obalem.

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
3. dipól - indukovaný dipól
Jak je zřejmé z předchozího textu, tato interakce se uplatňuje tehdy, jestliže se dostane nepolární molekula do blízkosti polární molekuly. Elektrické pole polární molekuly ovlivní rozložení elektronů v nepolární molekule – polarizuje ji za vzniku indukovaného dipólu. Ten pak interaguje s dalšími dipóly popřípadě indukovanými dipóly.

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
4. dipól - ion
Je to obdoba interakce dipól – dipól, jedním z interagujících partnerů není dipól, ale nabitá částice, tedy ion. Uplatňuje se např. ve vodných roztocích obsahujících ionty.

citováno z http://web.umr.edu/~gbert/INTERACT/intermolecular.HTM
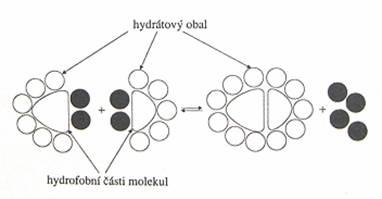
5. hydrofobní interakce
Zvláštním případem slabých vazebných interakcí jsou interakce hydrofobní. Tyto interakce se projevují v nepolárních částech molekul ve vodném prostředí, které mají tendenci se navzájem spojovat, a tím zmenšovat kontakt s polárními molekulami vody.