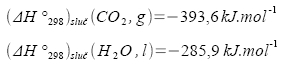Co je termochemie
Termochemie je oblast termodynamiky zabývající se studiem tepelného zabarvení chemických reakcí, tzn. zajímá se, zda se teplo při chemické reakci uvolňuje či spotřebovává. Tato tepelná energie vzniká nebo je spotřebována v důsledku štěpení vazeb ve výchozích látkách a vzniku nových vazeb v produktech. Na rozštěpení vazeb je třeba energii dodávat, zatímco při vzniku vazeb se energie uvolňuje.
Jak jsme zmiňovali, většina chemických reakcí probíhá za izobarických podmínek (konstantní tlak) a již bylo řečeno, že za těchto podmínek je reakční teplo rovno enthalpii ΔQp = ΔHp se všemi důsledky z toho plynoucími. Tyto reakce probíhající za izobarických podmínek dělíme reakce na exotermické a endotermické.
>>nahoru<<
Exotermické reakce
Reakce, při kterých systém teplo uvolňuje, se nazývají exotermické, tedy ΔH < 0 (změna enthalpie za konstantního tlaku je záporná), systém předal teplo do okolí a je o tuto energii chudší. Průběh těchto dějů může být doprovázen i světelnými efekty, například hořením. Mezi exotermní reakce patří například hoření železa v kyslíkové atmosféře, hoření hořčíkové pásky, ředění kyselin, katalytický rozklad peroxidu vodíku oxidem manganičitým, zapálení prskavky.

hoření ceru v kyslíkové atmosféře
Kromě „prudkých“ reakcí existují i reakce, ve kterých se také uvolňuje energie, a přitom nemusí hořet. Příkladem mohou být některé krystalizace.

příklad krystalizace modré skalice
Endotermické reakce
Reakce spojené se spotřebou tepla jsou označovány jako endotermické, pak ΔH > 0 (změna enthalpie za konstantního tlaku je kladná), systém od okolí energii přijal. Hovoříme o endotermických reakcích. Jsou to tedy reakce, kterým musíte dodávat energii. Například tepelný rozklad vápence.


pohled na vápenku v krajině a přímo v provozu

Standardní stav
Nyní se vrátíme k naší otázce, kolik tepla se uvolní při spálení 1 m3 methanu, kolik tepla spotřebujete a kolik za to zaplatíte. Malou obtíží je fakt, že reakční tepla závisí na okolních podmínkách jako je teplota, tlak a dokonce i stav reaktantů. Tzn., že jiné teplo se uvolní spalováním methanu při 20°C a jiné při 30°C. Stejně tak se jiné teplo uvolní při spálení 1 g diamantu (což nám mimochodem bude činit velké potíže) a při spálení 1 g grafitu (což už tak obtížné nebude). Abyste mohli reakční tepla navzájem porovnávat (například proto, jestli pro vytápění bude lepší použít methan nebo uhlí), je třeba zavést stejné podmínky pro všechny reakce, při nichž bude tato porovnání možné a praktické. Pokud byste to neučinili, bylo by to stejné, jako provnávat výkony běžců za krásného slunného dne nebo za hustého deště. Nabízí se ovšem otázka, jaké podmínky to budou? Proto byl stanoven stav nazývaný jako standardní. Tímto stavem je látka ve své nejstálejší modifikaci, teplotě 298,15 K a tlaku 101325 Pa. U uhlíku je například touto modifikací grafit, zatímco u vápence je to kalcit, obojí při teplotě 298,15 K a tlaku 101325 Pa.

Standardní reakční enthalpie
Potom teplo, které se uvolní, popřípadě spotřebuje při provedení chemické reakce s látkami ve standardním stavu, se nazývá standardní reakční teplo, nebo lépe standardní reakční enthalpie, protože jsme si řekli, že za izobarických podmínek je reakční teplo rovno enthalpii.
Standardní reakční enthalpie tedy udává změnu enthalpie určité reakce při teplotě 298,15 K (25°C) a tlaku 101,325 kPa. Standardní reakční enthalpii označujeme obvykle jako ΔH°298.
Pro zjednodušení budeme standardní reakční teplo pro reakci probíhající při teplotě 25°C značit ΔH°. Bude-li reakce probíhat při jiné teplotě, vyznačíme tuto teplotu indexem, např. ΔH°500. V tomto textu se naštěstí takovými reakcemi nebudeme dále zabývat.
Výpočty reakčních enthalpií provádíte na základě aplikace dvou termochemických zákonů, které úzce souvisí s tím, že enthalpie je stavová funkce.
1. termochemický zákon
formulovali v roce 1780 Lavoisier a Laplace. Proto se někdy říká Lavoisier-Laplaceův zákon.
Ten říká, že reakční enthalpie přímé a zpětné reakce jsou až na znaménka stejné. Přestože byl tento zákon formulován pouze pro jeden typ reakcí (rozložení sloučeniny na prvky = chemický rozklad), lze jej zobecnit i pro všechny ostatní reakce. Teplo, které je třeba dodat k reakci provedené jedním směrem je, až na znaménko, stejné jako teplo reakce zpětné.
Příklad:
![]()
![]()
Hodnota reakční enthalpie závisí mj. na teplotě, při níž reakce probíhá, ale také na skupenském stavu. U plynných reakčních složek na jejich tlaku. Proto v termochemických rovnicích musíte označit skupenský stav. Přechodem jednoho stavu do jiného, tzv. termodynamickým dějem, vyjadřuje změnu energie.
uvedené zkratky pocházejí z anglického názvu:
pevná látka – s (solid)
kapalná látka – l (liquid)
plynná látka – g (gas)
Vše si důkladně vysvětlíme na příkladu:
Vznik vody z prvků popisuje následující termochemická rovnice.
![]()
Řešení:
Z prvního termochemického zákona vyplývá, že reakční enthalpie rozkladu vody na prvky je až na znaménko stejná jako reakční enthalpie uvolněná při hoření vodíku v kyslíku.
![]()
Reakční enthalpie zpětné reakce je 483,6 kJ.mol-1.
Řešení je možné znázornit i graficky: Z diagramu je patrné, že hoření vodíku v kyslíku je reakce exotermní (teplo se uvolňuje), kdežto rozklad vody je reakce endotermní (teplo se spotřebuje).
2. termochemický zákon
formuloval v roce 1840 Hess
Reakční enthalpie kterékoliv chemické reakce nezávisí na způsobu jejího průběhu, ale pouze na počátečním a konečném stavu soustavy.
Na první pohled by se mohlo zdát, že tento zákon k ničemu nebude! Ale opak je pravdou! Fakt, že celková enthalpie reakce závisí pouze na počátečním a konečném stavu reakce vám umožňuje počítat reakční enthalpie reakcí, které jsou neproveditelné, těžko dostupné či vícestupňové, tedy takové probíhající přes meziprodukt. Příklad může být oxidace CO na CO2. Tuto reakci nelze prakticky provést, protože během spalování nelze připravit čistý CO jako meziprodukt a vždy připravíte směs CO a CO2. Přitom tato reakce má značný praktický význam, protože CO může být vedlejším produktem mnoha chemických syntéz a může být dále použit jako doplňkové palivo a zdroj energie. Přesto lze výpočet provést za předpokladu, že znáte reakční enthalpii ostatních reakčních kroků dané vícestupňové reakce a to naštěstí znáte.
![]()
(to je spalování grafitu, které se dá provést poměrně snadno)
A dále:
![]()
A hledáte reakční enthalpii této chemické reakce!
![]()
Vše lze také vyjádřit schématem:
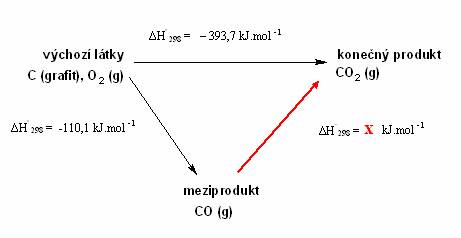
Lze také vyjádřit jiným (méně typickým) schématem:

Z druhého termochemického zákona vyplývá, že celkové tepelné zabarvení vícestupňové reakce je dáno součtem reakčních enthalpií všech dílčích reakcí. Tedy s termochemickými rovnicemi provádíte stejné algebraické operace (sčítání, odčítání, násobení čísly) jako v matematice s algebraickými rovnicemi. Stejné matematické operace pak provádíte s reakčními enthalpiemi. V našem případě
![]()
![]()
Reakční enthalpie oxidace grafitu na oxid uhelnatý je rovno – 283,6 kJ.mol-1.
Spalná a slučovací tepla
Výpočty se mohou ještě dále výrazně zjednodušit (pokud to takhle někomu nestačí), když zavedeme spalná a slučovací tepla. Nejprve si řekněme, co to jsou ona spalná a slučovací tepla.
Slučovací teplo sloučeniny je reakční teplo reakce, při níž vznikne jednotkové látkové množství (1 mol) této sloučeniny přímo z prvků v nejstálejším stavu za daných podmínek.
Spalné teplo sloučeniny je reakční teplo reakce, při níž se jednotkové látkové množství (1 mol) dané sloučeniny zoxiduje na nejstálejší oxidy anebo nejstálejší produkty oxidace.
Standardní spalná a slučovací tepla
Jsou-li látky ve standardním stavu za standardních podmínek, mluvíme o standardním slučovacím teple a o standardním spalném teple.
Standardní slučovací teplo dané látky (ΔH°T)sluč je standardní reakční teplo reakce, při které vznikne 1 mol této látky přímo z prvků ve standardním stavu za standardních podmínek, přičemž dané prvky jsou při zvolené teplotě a standardním tlaku ve své nejstálejší podobě. (Například při 25°C nás zajímá C (grafit) a ne diamant.)
Abyste dostali prvky ve standardním stavu, nebudete potřebovat žádné teplo. Proto standardní slučovací teplo prvků v jejich nejstálejší podobě je nulové a totéž platí při všech ostatních teplotách.
Standardní spalné teplo dané látky (ΔH°T)spal je standardní reakční teplo reakce, při které dojde ke spálení 1 molu této látky v nejstálejší podobě za standardních podmínek na konečné spalné produkty (obvykle nejstálejší oxidy, například u uhlíku je to CO2, u železa je to Fe2O3, apod.). Příklad – jeden triviální (methan spalování) a jeden složitější – amoniak.

Standardní spalná a standardní slučovací tepla můžete nalézt v chemických tabulkách. Jedny takové například visí na této adrese (http://www.vscht.cz/fch/frvs/html/tab/index.html).
Často se můžete setkat se symboly odlišnými od těch uvedených výše, například pro standardní slučovací teplo ΔHf° nebo (ΔH°T)f nebo ΔH°s a různé další obměny. To samé platí u standardního spalného tepla ΔHb° nebo (ΔH°T)b nebo ΔH°sp. Kde T značí příslušnou teplotu, k níž enthalpie náleží. Díky těmto hodnotám lze jednoduše spočítat reakční enthalpie všech „myslitelných“ reakcí (pokud vás ovšem nebude zajímat oxidace protaktinia). Jak to udělat vám napoví následující kapitola.
Výpočet reakčního tepla ze slučovacích a spalných tepel
Na základě druhého termochemického zákona můžete vypočítat standardní reakční teplo libovolné reakce, znáte-li standardní spalná nebo slučovací tepla výchozích látek a produktů.
a) Výpočet reakčního tepla ze slučovacích tepel
Postup je zřejmý z následujícího schématu zahrnujícího následující reakční kroky:
- přímá přeměna prvků na produkty
- přímá přeměna prvků na výchozí látky
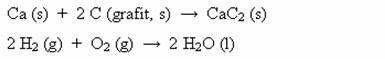
- výsledek (to, co chcete spočítat ΔH°T) – přeměna výchozích látek na produkty
![]()
Schematicky
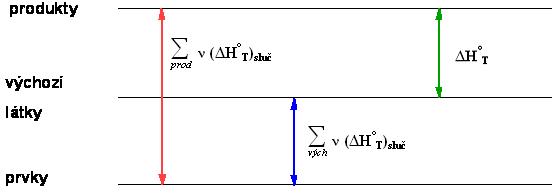
Je zřejmé, že pokud odečtete reakční tepla odpovídající přípravě výchozích látek přímo z prvků od reakčních tepel odpovídající přípravě produktů přímo z prvků, dostanete reakční teplo hledané reakce.
Nejdříve si uvedeme jednodušší verzi vzorce pro výpočet reakčního tepla z tepel slučovacích určenou pro ty, kteří nejsou zastánci řeckých písmen a matematických symbolů. Pro ně ale připomínám, že přicházejí o hodně.
Nechť je dána obecná reakce:
aA + bB ---› cC + dD
kde a, b, c, d jsou stechiometrické koeficienty látek A, B, C, D
A, B jsou výchozí látky
C, D jsou produkty,
jak to bude vypadat se znaménky u stechiometrických koeficientů?
pro výchozí látky a, b < 0
pro produkty c, d > 0.
Pak reakční teplo
![]()
Nyní tento jednoduchý vzorec přepíšeme pouze pomocí řeckého písmena velké sigma Σ (jakmile ji matematik uvidí, ví, že se jedná o součet, jinými slovy suma).
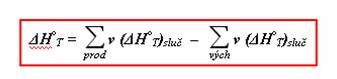
V žádném případě se nemusíte bát takhle dlouhého vzorce. Vypadá hrozivě. Ve skutečnosti je velice jednoduchý. Nejdříve si vysvětlíme jednotlivé symboly ve vzorci.
Σ… matematický symbol pro součet
![]() … vyjadřuje hodnotu stechiometrických koeficientů příslušných chemických látek
… vyjadřuje hodnotu stechiometrických koeficientů příslušných chemických látek
(ΔH°T)sluč … standardní slučovací teplo
Vyřešme si nyní příklad na výpočet reakčního tepla ze slučovacích tepel.
Vypočítejte reakční teplo (ΔH°) dané reakce při teplotě 298 K:
![]()
znáte-li standardní slučovací tepla výchozích látek:
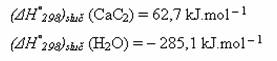
a standardní slučovací tepla produktů:
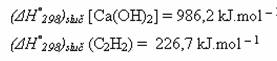
Řešení:
Nejdříve si do rovnice doplníte všechny stechiometrické koeficienty, pro lepší názornost i s jedničkami:
![]()
Nyní pouze dosadíte do vzorce.
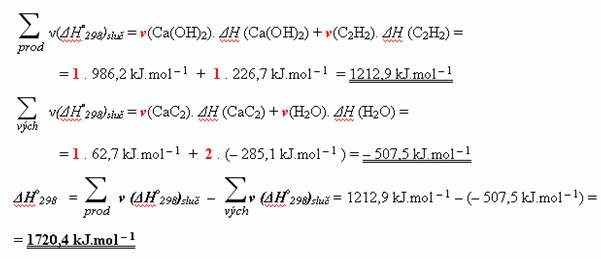
Změna enthalpie uvedené reakce je 1720,4 kJ.mol-1. Jedná se o endotermní reakci.

b) Výpočet reakčního tepla ze spalných tepel
Výpočet reakčních tepel z tepel spalných předpokládá provedení následujících dvou dějů, jejichž výsledkem je získání stejných konečných oxidačních produktů.
Postup je opět zřejmý z následujícího schématu zahrnujícího zmíněné reakční kroky:
- výchozí látky se spálí v kyslíku na nejstálejší oxidy
![]()
- produkty se spálí v kyslíku na nejstálejší oxidy
![]()
- výsledek (to, co chcete spočítat ΔH°T) – přeměna výchozích látek na produkty
![]()
Schematicky
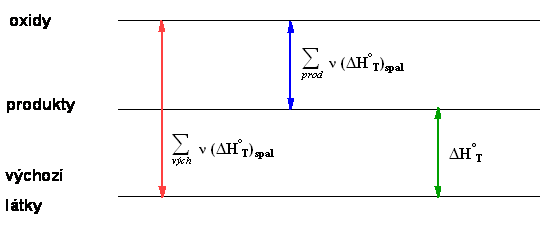
Je zřejmé, že pokud odečtete reakční tepla odpovídající přeměně produktů na jejich nejstálejší oxidy od reakčních tepel odpovídajících přeměně reaktantů na jejich nejstálejší oxidy, dostanete reakční teplo hledané reakce.
U tohoto typu výpočtu opět použijeme stejnou obecnou chemickou rovnici
aA + bB ---› cC + dD
kde a, b, c, d jsou stechiometrické koeficienty látek A, B, C, D
A, B jsou výchozí látky
C, D jsou produkty,
jak to bude vypadat se znaménky u stechiometrických koeficientů?
pro výchozí látky a, b > 0
pro produkty c, d < 0.
Při výpočtu reakčních tepel ze slučovacích tepel jsou znaménka stechiometrických koeficientů u výchozích látek a produktů obráceně, než je tomu u slučovacích tepel.
Pak reakční teplo
![]()
Nyní opět přepíšete tento vzorce pomocí sum
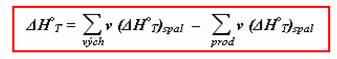
Příklad
Vypočítejte reakční teplo izomerizace dimethyletheru na ethanol,
![]()
znáte-li standardní spalná tepla výchozích látek:
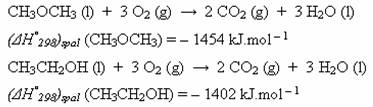
Řešení:
Nejdříve si do rovnice doplníte všechny stechiometrické koeficienty pro lepší názornost
![]()
Nyní pouze dosadíte do vzorce.
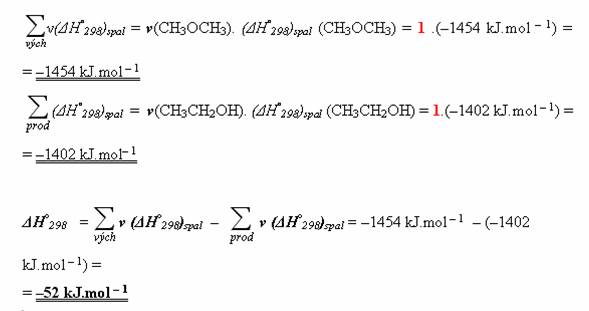
Změna enthalpie uvedené reakce je –52 kJ.mol-1. Jedná se o exotermní reakci.

Příklad
Na závěr si zkuste vypočítat reakční teplo reakce:
![]()
Víte-li, že slučovací tepla (enthalpie) jednotlivých látek v reakci:
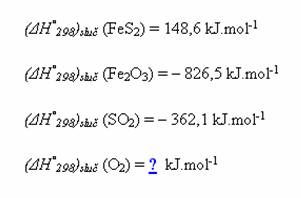
Nezapomeňte si rovnici správně vyčíslit!
Zjistěte také, kolik tepla se uvolní, jestliže do reakce vstoupí:
(B) 8 molů FeS2
(C) 1 mol FeS2
Řešení:


Úlohy
Úloha 1:
Do pyramidy zapište symboly chemických prvků, které jsou vždy součtem protonových čísel dvou předešlých. Poté si přečtete tajenku.
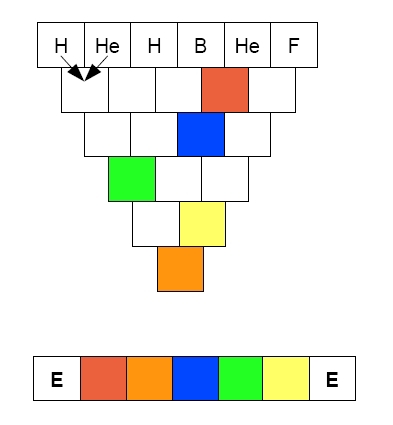
Úloha 2:
Vyplňte následující křížovku, jejíž slova se týkají vědní disciplíny, která zkoumá tepelné zabarvení chemických reakcí. Nyní následuje legenda.
-
Reakční teplo reakce, při které se jednotkové látkové množství dané látky zoxiduje na nejstálejší oxidy (konečné oxidační produkty).
-
Reakce, při které systém uvolňuje teplo do okolí.
-
Stupeň přeměny výchozích látek na produkty.
-
Reakce, které musíme dodat energii.
-
Reakční teplo reakce, při které vznikne jednotkové látkové množství této sloučeniny přímo z prvků.
-
Vzorec zemního plynu.
-
Zakladatel 2. termochemického zákona.
-
Jednotka reakčního tepla.
-
Zakladatel 1. termochemického zákona.
-
Energie, která se uvolní či spotřebuje při provedení dané reakce.
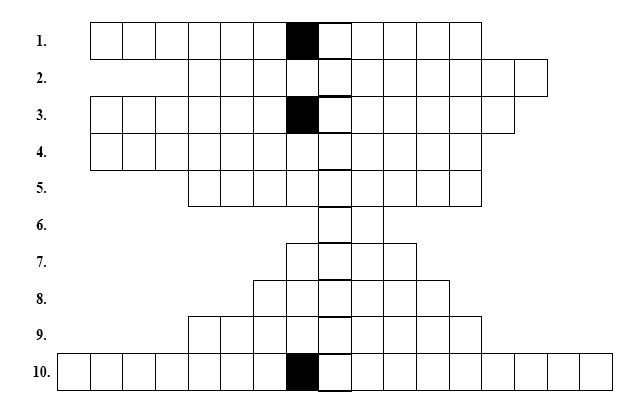
Úloha 3:
Následující chemické děje roztřiďte na exotermické a endotermické:

Úloha 4:
Následujícím chemickým reakcím přiřaďte správnou hodnotu reakčního tepla:
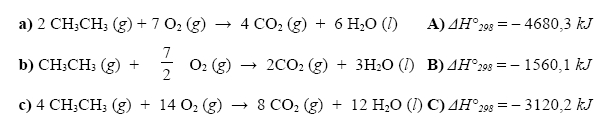
Zakroužkujte reakční teplo, které odpovídá reakci hoření ethanu:
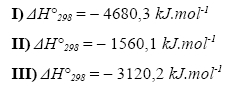
Úloha 5:
Pro které reakce je reakční teplo zároveň teplem slučovacím i spalným?
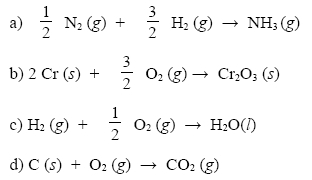
Úloha 6:
U které z reakcí můžeme reakční teplo označit jako spalné a u které jako slučovací?
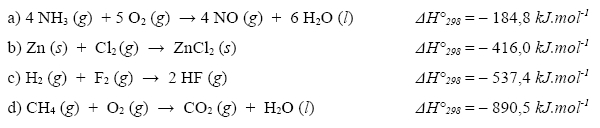
Úloha 7:

Úloha 8:
Vypočítejte standardní teplo hydrogenace ethenu při teplotě T = 298,15 K ze známých hodnot standardních spalných tepel pro tuto teplotu.
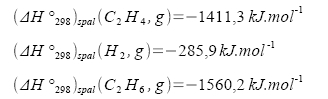
Úloha 9:
Určete standardní slučovací teplo benzenu při teplotě 25°C, znáte-li:
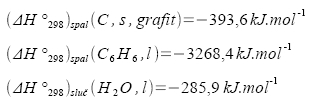
Úloha 10:
Vypočítejte standardní slučovací teplo glukosy, víte-li, že se při spálení 0,4 g glukosy (Mr = 180,16) uvolní 6220 J tepla.