Termodynamická teplota
K posuzování neuspořádaného pohybu částic, který se označuje jako tepelný pohyb, používáme teplotu. Při vyšší teplotě je střední rychlost látkových částic větší než při nižší teplotě. To znamená, že je větší i vnitřní energie tělesa. Pokles teploty je naopak projevem toho, že se vnitřní energie tělesa zmenšila. Při změnách skupenství dochází ke zvětšení nebo zmenšení potenciální energie částic, tedy mění se rovněž vnitřní energie těles.
Dotykem dokážeme rozlišit, zda jsou tělesa studená nebo teplá. Porovnání teplot na základě našich pocitů je velmi nepřesné. Při určování teploty používáme teploměry, např.
-
kapalinový – rtuťový a lihový. Rtuťovým teploměrem můžeme měřit teploty v rozsahu -30 °C a 300 °C, protože rtuť mrzne při -39 °C a naopak při 357 °C vře. Pro měření teplot vyšších než 300 °C se používají např. teploměry se rtutí, nad kterou je dusík, který brání vypařování rtuti. Takto upravený teploměr lze použít na měření teplot do 700 °C.
-
elektronický - použití při měření teploty chladicí kapaliny v automobilu
-
pyrometry - jsou založeny na skutečnosti, že tělesa zahřátá na tutéž teplotu vydávají záření stejné barvy
-
bimetalový teploměr - k měření teploty využívá bimetalový (dvojkový) pásek složený ze dvou kovů s různými teplotními součiniteli délkové roztažnosti. Při změně teploty se pásek ohýbá a tento pohyb se přenáší na ručku přístroje.
První teploměr v Evropě navrhl Galilei roku 1597. Ale teploměry založené na poznatku, že zahřátý plyn nebo kapalina zvětšují svůj objem, byly známky už ve starověké Alexandrii. Teploměr založený na teplotní roztažnosti rtuti v zatavené trubici zkonstruoval G. Fahrenheit roku 1714.
K ideálnímu řešení teploměru byly učiněny tři důležité kroky:
Anglický lékař D. Rutherford roku 1805 objevil dusík a přišel s myšlenkou plnit jím teploměry a W. Thomson (lord Kelvin) roku 1848 navrhl používat tlaku plynu (nikoli objemu) k určování teplot. Navíc navrhl posunout počátek teplotní stupnice do tzv. absolutní nuly, tj. na –273,15 °C = 0 K, kdy objem ideálního plynu by byl nulový.
Když Clausius na základě svých formulací základních vět termodynamiky definoval termodynamickou teplotu jako pojem nezávisející na jakékoli látce.
A když Boltzmann dokázal vztah mezi Clausiovou termodynamickou teplotou a statistickou teplotou, byla konečně termometrie postavena na pevný teoretický základ.
Nejpoužívanější teplotní stupnice:
Celsiova teplotní stupnice
Pro měření teploty (t) užíváme převážně jednotku Celsiův stupeň (°C). Pro praktická měření teploty se již od 18. století používá Celsiova teplotní stupnice, která je založena na dvou základních bodech (teplotách):
- teplota 0 °C je v podstatě teplota tání ledu a odpovídá rovnovážnému stavu směsi vody a ledu při normálním tlaku, tj. tlaku 101 325 Pa
Fahrenheitova teplotní stupnice
Dříve se v Evropě měřilo také teploměrem s Fahrenheitovou teplotní stupnicí. Nyní se tento teploměr používá hlavně v USA. Jednotkou v této stupnici je jeden Fahrenheitův stupeň. Vztah mezi teplotou t v Celsiově teplotní stupnici a teplotou f ve Fahrenheitově stupnici je vyjádřena výrazem
![]()
Termodynamická teplota
Snahou vědců bylo vytvořit teplotní stupnici nezávislou na náplni teploměru. Byla proto lordem Kelvinem téměř sto let po Celsiovi zavedena tzv. termodynamická teplotní stupnice. Je založena na jediné základní teplotě, která odpovídá teplotě rovnovážného stavu soustavy led + voda + sytá vodní pára. Tento rovnovážný stav se nazývá trojný bod vody a dohodou mu byla přiřazena teplota 273,16 K.
Počátek teplotní stupnice v kelvinech odpovídá teplotě, při které by ustal všechen neuspořádaný pohyb částic. Teploty 0 K nelze přesně dosáhnout, pouze se jí můžeme přiblížit, protože částice se v látkách vždy pohybují i když nepatrně. V současnosti bylo dosaženo teploty 1 mK. Z toho plyne, že teplota udávaná v kelvinech je vždy větší než nula. Teplotu měřenou v kelvinech označuje T. Číselná hodnota teploty vyjádřená v kelvinech je přibližně o 273,15 větší než v Celsiových stupních, např. 0 °C = 273,15 K.
Mezi dvěma různými teplotami určujeme teplotní rozdíl ![]()
Číselná hodnota teplotního rozdílu vyjádřená v kelvinech je stejná jako v Celsiových stupních.
Nejvyšší a nejnižší teploty
Nejnižší teplota v naší republice byla naměřena 11. 2. 1929 u Českých Budějovic, tehdy teploměr ukázal -42,2 °C. Nejnižší teplota na Zemi byla naměřena na jižním pólu, kde v roce 1947 klesla rtuť teploměru až na -97,5 °C. Nejchladnější teplotou, kterou sama příroda stvořila je reliktní záření (objevené roku 1965) o teplotě 2,7 K.
Nejvyšší teploty vzduchu zaznamenané v přírodě na naší planetě nepřesáhly 57 °C. Tato teplota byla zjištěna v Údolí smrti v Kalifornii. Ve Střední Asii, nejteplejší části Ruska, nebývají vedra větší než 50 °C. Všechny tyto teploty byly naměřeny ve stínu.
Člověk snese i teplotu 100 °C až 160 °C. Ale jen v tom případě, že se nedotýká přímo zdroje tepla a že okolní vzduch je suchý. Proto v oblastech, kde je vzduch vlhký, se poměrně špatně snáší už 24stupňové teplo.
Nejvyšší teploty dosažené lidskou činností vznikají v centru výbuchu termonukleární bomby a dosahují řádově 300 - 400 mil. °C. Z kontrolovatelných teplot se udává nejvyšší efektivní laboratorní teplota v reaktoru typu tokamak Princestonské laboratoře plazmové fyziky v USA z června 1986 a to 230 mil. °C.
Nejnižší teplota 3.10-8 K nad absolutním bodem mrazu byla dosažena ve dvoustupňovém jaderném kryostatu v Espoo ve Finsku v červnu 1984.

MAGDA VLACHOVÁ: Molekulová fyzika a termika [online]. [cit. 2008-07-03]. Dostupné z http://mfweb.wz.cz/fyzika/73.htm
Úloha 1:
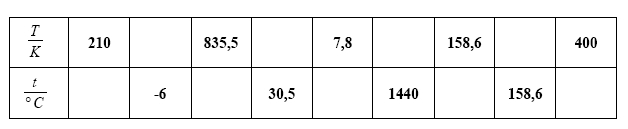
Doplňte chybějící údaje v tabulce:
Úloha 2:
Čím se od sebe liší zápisy T = 55 K a ΔT = 55 K ? Vyjádřete také oba zápisy v °C.
Úloha 3:
Vyjadřují zápisy t = 1020 °C a T = 1020 K tutéž teplotu? Své tvrzení zdůvodněte.

Definice a vztahy
Úloha 1:
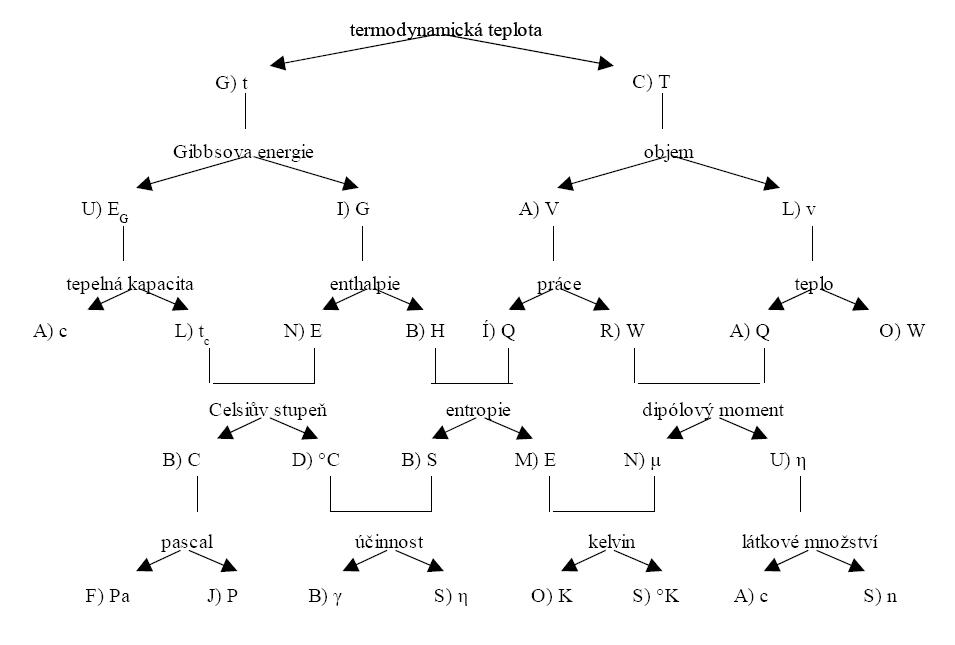
Vaším úkolem je správně přiřadit určité veličině správnou značku nebo symbol. Před každou značkou nebo symbolem je pak písmeno, které je částí tajenky. Půjdete-li tedy po „správné cestě“, přečtete si znění tajenky.
TAJENKOU je vědec, který v roce 1824 zjistil, že nejvyšší možná účinnost parního stroje (obecněji každého stroje přeměňující teplo na práci) závisí jen na teplotě teplejšího zásobníku (např. kotle) a na teplotě chladnějšího zásobníku (např. chladiče).
Úloha 2:
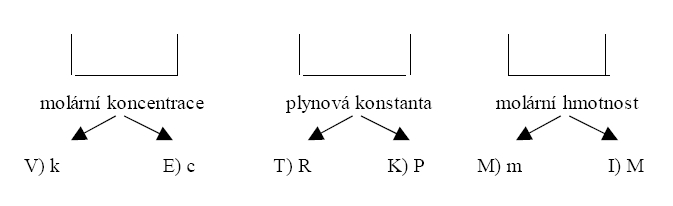
Vaším úkolem je správně přiřadit určité veličině správný definiční vztah. Před každým vztahem je pak písmeno, které je částí tajenky. Půjdete-li tedy po „správné cestě“ a přečtete si znění tajenky.
Babylonská věž
Patrně první dochovanou zmínkou o „viz tajenka“ je biblický příběh o stavbě Babylonské věže. Bůh mohl potrestat domýšlivé lidstvo různě: seslat na ně choroby, vyvolat zemětřesení, připravit je o materiál na stavbu věže. Rozhodl se seslat (viz tajenka). Zmatení jazyků, k němuž došlo, není nic jiného než vzrůst chaosu, tentokrát ve vzájemné komunikaci.
Stavová rovnice ideálního plynu
Ideální plyn
O ideálním plynu vyslovujeme 3 předpoklady:
-
Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul od sebe zanedbatelně malé.
-
Molekuly ideálního plynu mimo vzájemné srážky na sebe navzájem silově nepůsobí.
-
Vzájemné srážky molekul ideálního plynu a srážky těchto molekul se stěnami nádoby jsou dokonale pružné.
Plyn, který je v rovnovážném stavu, lze charakterizovat stavovými veličinami: termodynamickou teplotou T, tlakem p, objemem V a počtem molekul N (popř. látkovým množstvím n nebo hmotností plynu m). Rovnice, která vyjadřuje vztah mezi těmito veličinami, se nazývá stavová rovnice (i v případě ideálního plynu lze tuto rovnici napsat):
p.V = N.k.T
kde k je Boltzmannova konstanta, pro kterou platí k = 1,38.10-23 JK-1
Tuto rovnici lze napsat i v jiném, používanějším tvaru. Odvození je následující. Víme, že platí 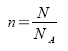 ,
,
pak dostaneme p.V = n.NA.k.T .
Zavedeme novou konstantu R, pro kterou platí následující vztah
![]() ,
,
kde R se nazývá molární plynová konstanta,
pak stavová rovnice vypadá takto
p.V = n.R.T
Potřebujeme-li pracovat s hmotností plynu, víme-li, že platí ![]() ,
,
pak lze odvodit vztah ![]()
obdobně, pracujeme-li s hustotou plynu ![]()
pro molární hmotnost látky platí ![]()
Za tzv. normální podmínky pokládáme stav plynu při tlaku 1,013 25·105 Pa (normální tlak) a za teploty 273, 15 K (normální teplota).
Úloha 1:
Zdůvodněte výpočtem, proč 1 mol ideálního plynu zaujímá objem 22,4 dm3 za normálních podmínek.
Úloha 2:
Dopravní letadla létají ve výšce 10 km, kde se teplota vzduchu pohybuje okolo -40 °C a tlak okolo 30 kPa. Jaký je poměr hustoty vzduchu v této výšce k hustotě na zemském povrchu při teplotě 15 °C a tlaku 101 kPa?

Úloha 3:
Kolik molekul je za normálních podmínek obsaženo v ideálním plynu o objemu 2 cm3 ? Jak dlouho by trvalo jeho vyčerpání, kdybychom za každou sekundu ubrali 107 molekul? Předpokládejme stejnoměrné čerpání vzduchu.
Úloha 4:
V nádobě o objemu 4 litry je molekula dusíku N2 o hmotnosti 55 g a teplotě 26 °C. Jaký je jeho tlak ? Dusík za daných podmínek považujeme za ideální plyn.

Úloha 5:
Jak se změní průměr balónku ve tvaru koule, jestliže byl při teplotě -10 °C nafouknut vzduchem na průměr 50 cm a pak přenesen do místnosti s teplotou 25 °C ? Předpokládejte, že tlak uvnitř balónku zůstává stejný.

Úloha 6:
Střední molární hmotnost vzduchu je 29 g.mol-1. Jaká je hmotnost vzduchu v místnosti o rozměrech 3m x 5m x 4m při teplotě 25 °C a tlaku 101 kPa ?
Úloha 7:
Lidské plíce vydrží přetlak přibližně 0,1 MPa. Pokud by nedocházelo k interakci vzduchu s tkání, jaký přetlak by se vytvořil v plicích po plném nadechnutí mrazivého vzduchu při teplotě - 25 °C a zadržení dechu tak, aby se všechen ohřál na 36 °C ?
Úloha 8:
Kolik pouťových balónků naplněných vodíkem do tvaru koule o průměru 30 cm by při teplotě 25 °C a tlaku 101 kPa uneslo člověka vážícího 70 kg ? Hmotnost jednoho balónku je 8 g. Balónek považujeme za kouli.
Úloha 9:
Na oběžné dráze se nachází raketa o objemu 10 m3. Uvnitř je vakuum. Vpravíme dovnitř 1 cm3 (1 g) vody. Určete tlak vodních par, který vznikne v raketě. Teplota lodi i vody je 100 K.
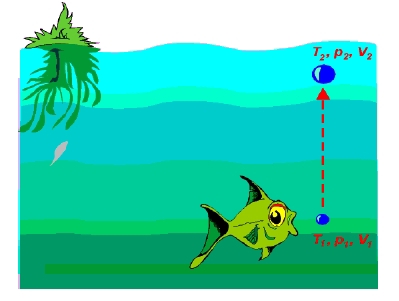
Úloha 10:
Ryba vypustí na dně rybníka, v hloubce 5 m, bublinu (T = 10 °C, V = 1 cm3). Určete její objem na povrchu rybníka (T = 20 °C). Zanedbejte absorpci molekul plynu do vody (N = konst.).
Úloha 11:
William Ramsay se roku 1894 na přednášce lorda Rayleighe dozvěděl, 1 dm3 čistého dusíku vyrobeného chemickou reakcí váží 1,2505 g, ale 1 dm3 dusíku vyrobeného ze vzduchu po odstranění kyslíku, oxidu uhličitého a vodní páry váží 1,2572 g (oba objemové údaje byly měřeny při stejné teplotě a tlaku). Rayleigh se domníval, že chemicky vyrobený dusík byl kontaminován lehčí nečistotou, Ramsay naopak předpoládal, že nějaká nečistota, a to těžší, je přítomna v atmosférickém dusíku. Nechal proto procházet dusík přes do ruda rozžhavený hořčík, na němž se tvořil nitrid hořečnatý. Po trojím průchodu zbylo z 22 litrů atmosférického dusíku 290 cm3 nezreagovaného plynu o neměnné hustotě. Měřením měrného tepla se ukázalo, že je tento plyn monoatomární. Jaký plyn izoloval W. Ramsay, byla-li při teplotě 25 °C a tlaku 100 kPa jeho hustota je 1,63 g.dm-3 ?